
氢氧燃料电池是以氧气作为氧化剂,以氢气作为燃料,然后通过燃料的各种化学反应,进而将产生的化学能转化为电能有一种电池。氢氧燃料电池具有容量大、比能量高、转化效率高和功率范围广等多个优点。氢氧燃料电池和一般电池有着很大区别,一般电池的活性物质是被存放在电池的内部的,所以储存的活性物质的量的多少决定电池的容量。而燃料电池的活性物质是可以被源源不断地输入的。今天小编就来给大家介绍一下氢氧燃料电池的一些知识。
氢氧燃料电池的分类
氢氧燃料电池按电池结构和工作方式分为离子膜、培根型和石棉膜三类。
1、离子膜氢氧燃料电池
用阳离子交换膜作电解质的酸性燃料电池,现代采用全氟磺酸膜。电池放电时,在氧电极处生成水,通过灯芯将水吸出。这种电池在常温下工作、结构紧凑、重量轻,但离子交换膜内阻较大,放电电流密度小。
2、培根型燃料电池
属碱性电池。氢、氧电极都是双层多孔镍电极(内外层孔径不同),加铂作催化剂。电解质为80%~85%的苛性钾溶液,室温下是固体,在电池工作温度(204~260°C)下为液体。这种电池能量利用率较高,但自耗电大,起动和停机需较长的时间(起动需24小时,停机17小时)。
3、石棉膜燃料电池
也属碱性电池。氢电极由多孔镍片加铂、钯催化剂制成,氧电极是多孔银极片,两电极夹有含35%苛性钾溶液的石棉膜,再以有槽镍片紧压在两极板上作为集流器,构成气室,封装成单体电池。放电时在氢电极一边生成水,可以用循环氢的办法排出,亦可用静态排水法。这种电池的起动时间仅15分钟,并可瞬时停机。比磷酸铁锂电池要更环保。
氢氧燃料电池的优点
1、材料价廉
2、操作简单
3、安全
4、高效
5、无污染
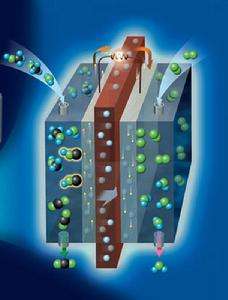
氢氧燃料电池工作原理

燃料电池是一种化学电池,它利用物质发生化学反应时释出的能量,直接将其变换为电能。从这一点看,它和其他化学电池如锰干电池、铅蓄电池等是类似的。但是,它工作时需要连续地向其供给反应物质——燃料和氧化剂,这又和其他普通化学电池不大一样。由于它是把燃料通过化学反应释出的能量变为电能输出,所以被称为燃料电池。具体地说,燃料电池是利用水的电解的逆反应的“发电机”。它由正极、负极和夹在正负极中间的电解质板所组成。最初,电解质板是利用电解质渗入多孔的板而形成,现在正发展为直接使用固体的电解质。
工作时向负极供给燃料(氢),向正极供给氧化剂(空气,起作用的成分为氧气)。氢在负极分解成正离子H+和电子e-。氢离子进入电解液中,而电子则沿外部电路移向正极。用电的负载就接在外部电路中。在正极上,空气中的氧同电解液中的氢离子吸收抵达正极上的电子形成水。这正是水的电解反应的逆过程。
利用这个原理,燃料电池便可在工作时源源不断地向外部输电,所以也可称它为一种“发电机”。
一般来讲,书写燃料电池的化学反应方程式,需要高度注意电解质的酸碱性。在正、负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系。如氢—氧燃料电池有酸式和碱式两种,在酸溶液中负极反应式为:2H2-4e-==4H+ 正极反应式为:O2 + 4H+ +4eˉ== 2H2O;如是在碱溶液中,则不可能有H+出现,在酸溶液中,也不可能出现OHˉ。
若电解质溶液是碱、盐溶液则负极反应式为:2H2 + 4OHˉ-4eˉ== 4H20 正极为:O2 + 2H2O + 4eˉ== 4OHˉ
若电解质溶液是酸溶液则负极反应式为:2H2-4eˉ=4H+(阳离子),正极为:O2+4eˉ+4H+=2H2O
记忆规律如下:
碱性条件下,容易记住正极的O2、H2O、eˉ、4OHˉ前面的系数分别为1、2、2、4,再用总反应方程式减去上式即可。酸性条件下,易记住负极反应式(4H+)+(-4eˉ)=2H2,通过移项可以得到所需要的方程式,同样用总反应式减上式得到正极反应式。
氢氧燃料电池工作时,向氢电极供应氢气,同时向氧电极供应氧气。氢、氧气在电极上的催化剂作用下,通过电解质生成水。这时在氢电极上有多余的电子而带负电,在氧电极上由于缺少电子而带正电。接通电路后,这一类似于燃烧的反应过程就能连续进行。
电极反应式
氢氧燃料电池(中性介质):
正极:O2 + 2H2O + 4e- → 4OH-
负极:2H2 - 4e- → 4H+
总反应式:2H2 + O2 == 2H2O
氢氧燃料电池(酸性介质):
正极:O2 + 4H+ + 4e- → 2H2O
负极:2H2 - 4e-→ 4H+
总反应式:2H2 + O2 == 2H2O
氢氧燃料电池(碱性介质):
正极:O2 + 2H2O + 4e- → 4OH-
负极:2H2 - 4e- + 4OH- → 4H2O
总反应式:2H2 + O2 == 2H2O

- 最新评论
- 我的评论
